AEBI Schmidt heeft geen spoedeisend belang bij haar vorderingen en wordt niet ontvankelijk verklaard
Vzr. Rechtbank Den Haag 2 oktober 2015, IEF 15301 (AEBI Schmidt Nederland tegen Rondaan Transportservice) Octrooirecht. Aebi is houdster van het Nederlands deel van EP0995838 voor een "Vrachtwagen met een daarop afneembaar opgebouwd opzetwerktuig". Rondaan is een gespecialiseerde fabrikant van transportmiddelen, laad-en lossystemen en wegbeheermaterieel en verrichten zij periodieke keuringen, onderhoud en reparaties. Rondaan is gesommeerd door Aebi om het aanbieden van de opzetzoutstrooier te staken en gestaakt te houden omdat zij daarmee inbreuk maakt op het Nederlandse deel van EP838. Aebi heeft geen bodemprocedure ingesteld en een kort geding is er ook niet van gekomen. Aebi heeft niet kunnen aannemen dat de dreiging van inbreuk was weggevallen. Rondaan heeft zich uitdrukkelijk op het standpunt gesteld dat van inbreuk geen sprake kan zijn omdat EP838 nietig is. Rondaan heeft zich stevig verzet tegen het niet accepteren van haar opzetzoutstrooier en heeft haar positie in de markt met hand en tand verdedigd. Dit moet voor Aebi duidelijk zijn geweest. Aebi wordt daarom niet ontvankelijk verklaard in haar vorderingen omdat een spoedeisend belang ontbreekt.
Octrooirecht. Aebi is houdster van het Nederlands deel van EP0995838 voor een "Vrachtwagen met een daarop afneembaar opgebouwd opzetwerktuig". Rondaan is een gespecialiseerde fabrikant van transportmiddelen, laad-en lossystemen en wegbeheermaterieel en verrichten zij periodieke keuringen, onderhoud en reparaties. Rondaan is gesommeerd door Aebi om het aanbieden van de opzetzoutstrooier te staken en gestaakt te houden omdat zij daarmee inbreuk maakt op het Nederlandse deel van EP838. Aebi heeft geen bodemprocedure ingesteld en een kort geding is er ook niet van gekomen. Aebi heeft niet kunnen aannemen dat de dreiging van inbreuk was weggevallen. Rondaan heeft zich uitdrukkelijk op het standpunt gesteld dat van inbreuk geen sprake kan zijn omdat EP838 nietig is. Rondaan heeft zich stevig verzet tegen het niet accepteren van haar opzetzoutstrooier en heeft haar positie in de markt met hand en tand verdedigd. Dit moet voor Aebi duidelijk zijn geweest. Aebi wordt daarom niet ontvankelijk verklaard in haar vorderingen omdat een spoedeisend belang ontbreekt.
4.6. Het eerste argument overtuigt de voorzieningenrechter geenszins. Naar voorlopig oordeel heeft Aebi niet kunnen aannemen dat de dreiging van inbreuk was weggevallen. In de eerste plaats niet omdat Rondaan c.s. geen gehoor heeft gegeven aan de sommatie van 12 augustus 2014 en ook de daaraan gehechte onthoudingsverklaring, de dreigende taal van de sommatie ten spijt, niet heeft getekend. Integendeel, Rondaan c.s. heeft zich uitdrukkelijk op het standpunt gesteld dat van inbreuk geen sprake kan zijn omdat EP 838 nietig is. Een opinie van de octrooigemachtigde van Rondaan c.s. met die strekking is door de advocaat van Rondaan c.s. aan de advocaat van Aebi doorgestuurd. In de tweede plaats geldt, zo is ter zitting duidelijk geworden, dat Rondaan c.s. zich stevig heeft verzet tegen het door de hiervoor genoemde provincies niet accepteren van haar opzetzoutstrooier en de uiteindelijke intrekking van de aanbesteding. Rasco heeft zelfs een kort geding tegen beide provincies gevoerd (vgl. 2.9.). Hoewel zij dit kort geding heeft verloren, moet het voor Aebi duidelijk zijn geweest dat Rondaan c.s. haar positie in de markt met hand en tand verdedigde, zodat
dreiging van inbreuk, in ieder geval bestaande in inschrijving bij nieuwe aanbestedingen, bepaald aanwezig was. Dat Aebi hier klaarblijkelijk ook rekening mee hield, volgt uit het gegeven dat de advocaat van Aebi, zoals ter zitting is toegelicht, medio april 2015 met de advocaat van Rondaan c.s. contact heeft opgenomen om de positie van Rondaan c.s. af te tasten in verband met een nieuwe aanbesteding later in het jaar.
4.7. Het tweede argument kan op zich worden ingezien maar is een keuze die voor rekening en risico van Aebi dient te blijven.
 Van de
Van de  Bijdrage ingezonden door Cees Mulder,
Bijdrage ingezonden door Cees Mulder, 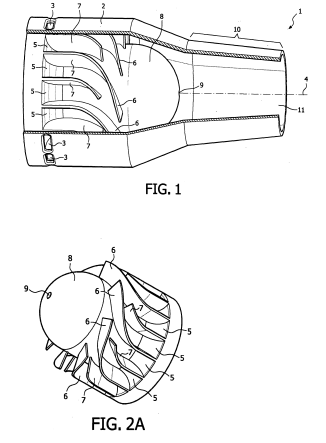 Octrooirecht. Ascom en FMC houden zich beiden bezig met ontwikkeling en verkoop van separatietechnologieën. Ascom is licentienemer van het
Octrooirecht. Ascom en FMC houden zich beiden bezig met ontwikkeling en verkoop van separatietechnologieën. Ascom is licentienemer van het  Uitspraak ingezonden door Tjeerd Overdijk en Peter Ras,
Uitspraak ingezonden door Tjeerd Overdijk en Peter Ras, 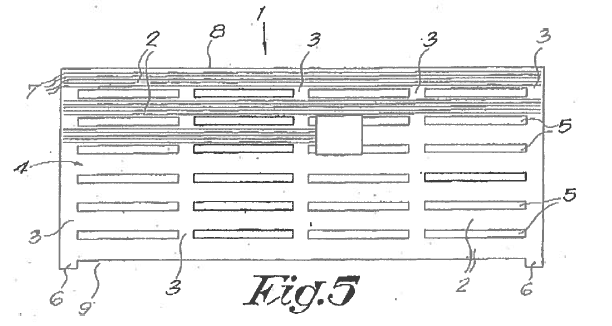 Uitspraak ingezonden door Eliëtte Vaal en Peter Claassen,
Uitspraak ingezonden door Eliëtte Vaal en Peter Claassen,  Octrooirecht. Plantlab is rechthebbende van
Octrooirecht. Plantlab is rechthebbende van  Civiel recht. Website. Licentievergoeding. Danone is bij dagvaarding van 21 juni 2012 in hoger beroep gekomen van de onder bovenvermeld zaak-/rolnummer uitgesproken vonnissen van 8 juni 2011 (hierna ook: het tussenvonnis) en 20 juni 2012 (het eindvonnis) van de rechtbank Amsterdam, sector civiel recht, in deze zaak gewezen tussen Globalocity als eiseres en Danone als gedaagde. Het Hof vernietigt het eindvonnis van de rechtbank. In deze zaak gaat het over overeenkomsten over ontwerp en ontwikkeling van internet en website, onderhoud, beheer, support en licentierechten. De leverancier vordert 1,8 miljoen, de rechtbank wijst 1,3 miljoen toe en het Hof een half miljoen. Er is een cassatieberoep ingesteld.
Civiel recht. Website. Licentievergoeding. Danone is bij dagvaarding van 21 juni 2012 in hoger beroep gekomen van de onder bovenvermeld zaak-/rolnummer uitgesproken vonnissen van 8 juni 2011 (hierna ook: het tussenvonnis) en 20 juni 2012 (het eindvonnis) van de rechtbank Amsterdam, sector civiel recht, in deze zaak gewezen tussen Globalocity als eiseres en Danone als gedaagde. Het Hof vernietigt het eindvonnis van de rechtbank. In deze zaak gaat het over overeenkomsten over ontwerp en ontwikkeling van internet en website, onderhoud, beheer, support en licentierechten. De leverancier vordert 1,8 miljoen, de rechtbank wijst 1,3 miljoen toe en het Hof een half miljoen. Er is een cassatieberoep ingesteld.




















































































