In conventie:
3.1. WWTS vordert in conventie - samengevat- dat de rechtbank bij vonnis, uitvoerbaar bij voorraad,
Ten aanzien van het auteursrecht:
- voor recht verklaart dat met de openbaarmaking en verveelvoudiging van 7.121 exemplaren van de IQonn Software, versie 4, gedaagden ieder voor zich en/of afzonderlijk inbreuk hebben gemaakt op de bij WWTS berustende auteursrechten met betrekking tot de IQonn software, versie 4,
- gedaagden hoofdelijk veroordeelt tot afdracht van de met de inbreuk genoten winst aan WWTS, dan wel voldoening aan haar van de schade ter zake van deze inbreuk op auteursrechten tot een bedrag ad 534.074 euro te vermeerderen met de wettelijke handelsrente, althans gedaagden hoofdelijk veroordeelt tot voldoening van de schade aan de zijde van WWTS ter zake van deze inbreuk op auteursrechten, welk bedrag der zake is op te maken bij staat en te vereffenen volgens de wet,
Ten aanzien van het octrooi:
- voor recht verklaart dat gedaagden gezamenlijk en/of ieder afzonderlijk met de productie, het aanbieden, het in voorraad hebben, de verkoop en de levering van exemplaren van de als Toughbooks aangeduide typen computerapparatuur inbreuk hebben gemaakt en maken op EP 882,
- gedaagden, gezamenlijk en/of ieder afzonderlijk, gelast de productie, het aanbieden, het in voorraad hebben, de verkoop en de levering van exemplaren van de als Toughbooks aangeduide typen computerapparatuur, in Nederland te staken en gestaakt te houden, op straffe van een dwangsom,
- gedaagden hoofdelijk veroordeelt tot vergoeding van de schade, die te rekenen vanaf de datum van octrooiverlening is veroorzaakt door de op EP 882 inbreuk makende handelingen, en tot afdracht van de winst die door gedaagden gezamenlijk en/of ieder afzonderlijk is behaald met de productie, het aanbieden, de verkoop en de levering van de als Toughbooks aangeduide typen computerapparatuur, in Nederland, zulks op te maken bij staat en te vereffenen volgens de wet,
- gedaagden gelast om opgave, voorzien van een goedkeurende verklaring van een registeraccountant, te doen aan WWTS van het aantal geproduceerde en verkochte, althans in Nederland geleverde typen computerapparatuur, waarin de inbreukmakende connection management methoden werden toegepast, de duur waarbinnen en de tijdstippen waarop deze productie, verkoop en leveringen hebben plaatsgevonden en de productiekosten en de verkoopprijs van geproduceerde, verkochte en geleverde exemplaren van de inbreukmakende typen computerapparatuur, eveneens op straffe van een dwangsom,
Ten aanzien van de proceskosten:
- met veroordeling van Panasonic in de proceskosten overeenkomstig artikel 1019h Rv.
3.2. WWTS stelt daartoe -kort gezegd- dat Panasonic 7.121 Toughbooks heeft voorzien van IQonn Software, versie 4, zonder dat zij daartoe een licentie had van WWTS. Panasonic had slechts een licentie voor versie 3 gekregen. Bij gebruik van de Toughbooks van Panasonic wordt voorts door de daarop geïnstalleerde software de werkwijze van (conclusie 1 van) het octrooi toegepast, zodat sprake is van indirecte inbreuk door Panasonic.
3.3. Panasonic voert hiertegen gemotiveerd verweer, onder meer stellende dat zij wel degelijk versie 4 een licentie had gekregen en betaald. Verder is er volgens haar geen sprake van een octrooi-inbreuk, niet alleen omdat geen sprake is van toepassing van alle maatregelen uit de conclusie maar voorts omdat sprake is van een nietig octrooi, omdat het toegevoegde materie bevat en niet inventief is.
4. De beoordeling
Auteursrecht
4.2. WWTS stelt dat sprake is van inbreuk op haar auteursrechten ter zake de IQonn software. Panasonic bestrijdt dat met de stelling enerzijds dat zij de verspreiding van de software heeft gestaakt en anderzijds dat zij voordien toestemming daartoe had krachtens een licentie van Diginext. De rechtbank overweegt als volgt.
4.3. WWTS heeft onvoldoende onderbouwd gesteld dat Panasonic thans nog de software verspreidt of anderszins software zou hebben verspreid waarvoor zij geen afdracht heeft gedaan van een licentievergoeding aan Diginext dan wel WWTS. De zaak spitst zich dan ook toe op de vraag of de TC V4 die Panasonic bij 7121 Toughbooks heeft meegeleverd, onder de licentie viel of niet. De rechtbank is van oordeel dat dit het geval is, waarbij zij de volgende omstandigheden in aanmerking heeft genomen.
(...)
Octrooirecht
(...)
4.25. Zodoende zou de gemiddelde vakman zonder inventieve denkarbeid komen tot de in conclusie 1 van het octrooi neergelegde maatregelen, ook als deze wordt gelezen in de beperkte zin als door WWTS voorgestaan.
Slotsom en proceskosten
4.26. De slotsom luidt dat conclusie 1 van het octrooi voor nietig is te houden, zodat de daarop gebaseerde vorderingen afgewezen moeten worden. Voorts doet Panasonic wat betreft de auteursrechten terecht een beroep op het bestaan van OEM Licentie, waarmee ook die grondslag van de vorderingen niet kan opgaan. Het in conventie gevorderde moet om die reden worden afgewezen. Gelet op de voorwaarden waaronder de reconventie is ingesteld, komt de rechtbank daaraan niet toe.
 Alle vraagstukken die het waarderen van bedrijven en ondernemingen zo lastig kunnen maken doen zich extra hardnekkig voor bij het waarderen van intellectuele eigendomsrechten. De verleiding van pseudo-benaderingen is dan ook sterk. Toch zou juist bij die waarderingen het gehele instrumentarium van de valuator benut moeten worden, om zo tot een degelijke en doordachte waarde te komen.
Alle vraagstukken die het waarderen van bedrijven en ondernemingen zo lastig kunnen maken doen zich extra hardnekkig voor bij het waarderen van intellectuele eigendomsrechten. De verleiding van pseudo-benaderingen is dan ook sterk. Toch zou juist bij die waarderingen het gehele instrumentarium van de valuator benut moeten worden, om zo tot een degelijke en doordachte waarde te komen. Uitspraak ingezonden door Rien Broekstra, Ruprecht Hermans en Richard Ebbink,
Uitspraak ingezonden door Rien Broekstra, Ruprecht Hermans en Richard Ebbink,  Auteursrecht. Octrooirecht. Software. WWTS voert aan dat Panasonic auteursrechtinbreuk heeft gemaakt op de IQonn Software, versie 4, door openbaarmaking en verveelvoudiging van 7121 exemplaren. Daarnaast eist WWTS staking van o.a. de verkoop en levering van exemplaren van de als Toughbooks aangeduide typen computerapparatuur. Panasonic brengt met succes er tegen in dat zij een licentie hadden voor de IQonn Software die meegeleverd zat bij de Toughbooks. Ook het octrooi (dat ziet op het updaten van "data") is voor nietig te houden volgens de rechtbank, zodat de daarop gebaseerde vorderingen afgewezen moeten worden.
Auteursrecht. Octrooirecht. Software. WWTS voert aan dat Panasonic auteursrechtinbreuk heeft gemaakt op de IQonn Software, versie 4, door openbaarmaking en verveelvoudiging van 7121 exemplaren. Daarnaast eist WWTS staking van o.a. de verkoop en levering van exemplaren van de als Toughbooks aangeduide typen computerapparatuur. Panasonic brengt met succes er tegen in dat zij een licentie hadden voor de IQonn Software die meegeleverd zat bij de Toughbooks. Ook het octrooi (dat ziet op het updaten van "data") is voor nietig te houden volgens de rechtbank, zodat de daarop gebaseerde vorderingen afgewezen moeten worden. Uitspraak mede ingezonden door Paul Reeskamp en Marijn van der Wal,
Uitspraak mede ingezonden door Paul Reeskamp en Marijn van der Wal,  Schadestaatprocedure. Begroting schade ten gevolge van niet-nakoming verplichting tot op naam van eiser stellen octrooi. Schadepost (a) - de schade bestaande uit gederfde positieve contractwaarde van de licentieovereenkomst - wordt toegewezen. De concept licentie-overeenkomst tussen Inno Nautic en Vetus omschreven de royalties in drie tranches een bedrag van €150.000. De overige schadeposten - kosten herstelprocedures, verlies van de mogelijkheid tot verkrijgen van octrooibescherming in andere landen, schade als gevolg van het faillissement van Inno Nautic en kosten voor de schadebegroting - worden afgewezen.
Schadestaatprocedure. Begroting schade ten gevolge van niet-nakoming verplichting tot op naam van eiser stellen octrooi. Schadepost (a) - de schade bestaande uit gederfde positieve contractwaarde van de licentieovereenkomst - wordt toegewezen. De concept licentie-overeenkomst tussen Inno Nautic en Vetus omschreven de royalties in drie tranches een bedrag van €150.000. De overige schadeposten - kosten herstelprocedures, verlies van de mogelijkheid tot verkrijgen van octrooibescherming in andere landen, schade als gevolg van het faillissement van Inno Nautic en kosten voor de schadebegroting - worden afgewezen. Octrooirecht. Onderneming houdster van een standaard-essentieel octrooi, die zich jegens een standaardisatieorganisatie de verbintenis is aangegaan aan derden licenties te verlenen onder eerlijke, redelijke en niet-discriminerende voorwaarden, genoemd ‚FRAND’(‚fair, reasonable and non-discriminatory’)-voorwaarden – Misbruik van machtspositie – Beroepen wegens inbreuk – Vordering tot staken – Vordering tot terugroeping van producten – Vordering tot verstrekking van boekhoudkundige gegevens uit het verleden (toegestaan) – Vordering tot schadevergoeding – Verplichtingen van de houder van het standaard-essentieel octrooi. Het hof verklaart voor recht:
Octrooirecht. Onderneming houdster van een standaard-essentieel octrooi, die zich jegens een standaardisatieorganisatie de verbintenis is aangegaan aan derden licenties te verlenen onder eerlijke, redelijke en niet-discriminerende voorwaarden, genoemd ‚FRAND’(‚fair, reasonable and non-discriminatory’)-voorwaarden – Misbruik van machtspositie – Beroepen wegens inbreuk – Vordering tot staken – Vordering tot terugroeping van producten – Vordering tot verstrekking van boekhoudkundige gegevens uit het verleden (toegestaan) – Vordering tot schadevergoeding – Verplichtingen van de houder van het standaard-essentieel octrooi. Het hof verklaart voor recht: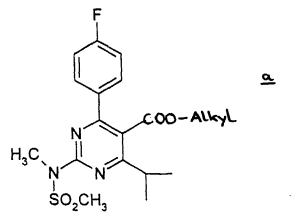 Octrooirecht. ABC. Afstandsleer. Shionogi is farmaceutische onderneming en houdster van ABC 300125 voor 'Rosuvastatinum, desgewenst in de vorm van een niet-toxisch farmaceutisch aanvaardbaar zout, in het bijzonder het calciumzout', voorheen houdster van EP471 'Pyrimidinederivaten als HMG-CoA-reductase-inhibitoren’. Resolution vordert met succes de partiële nietigheid van het octrooi en ABC vanwege toegevoegde materie; voor zover de bescherming ervan zich uitstrekt over andere producten dan in EP 471 genoemde niet-toxische farmaceutisch aanvaardbare zouten van rosuvastatine.
Octrooirecht. ABC. Afstandsleer. Shionogi is farmaceutische onderneming en houdster van ABC 300125 voor 'Rosuvastatinum, desgewenst in de vorm van een niet-toxisch farmaceutisch aanvaardbaar zout, in het bijzonder het calciumzout', voorheen houdster van EP471 'Pyrimidinederivaten als HMG-CoA-reductase-inhibitoren’. Resolution vordert met succes de partiële nietigheid van het octrooi en ABC vanwege toegevoegde materie; voor zover de bescherming ervan zich uitstrekt over andere producten dan in EP 471 genoemde niet-toxische farmaceutisch aanvaardbare zouten van rosuvastatine. Uitspraak ingezonden door namens Otto Swens en Ricardo Dijkstra,
Uitspraak ingezonden door namens Otto Swens en Ricardo Dijkstra,  Octrooirecht. Zie eerder AG [
Octrooirecht. Zie eerder AG [ Octrooirecht. Incident. Zaak verwijderd uit het versnelde regime voor de octrooiprocedure omdat de aanhouding van de behandeling van de inbreukvraag op
Octrooirecht. Incident. Zaak verwijderd uit het versnelde regime voor de octrooiprocedure omdat de aanhouding van de behandeling van de inbreukvraag op 




















































































