De Syngenta-ABC-uitspraak landmark-case in Life Sciences
 Bijdrage ingezonden door Rogier de Vrey, CMS. In de zaak Syngenta/Octrooicentrum NL [IEF 14669] speelden aspecten van octrooirecht / aanvullend beschermingscertificaat, bestuursrecht en Europees recht. Deze zaak is behandeld door mij, tezamen met mijn Nederlandse kantoorgenoten Conny Delissen (bestuursrecht), Willem Hoorneman (net als ik octrooirecht) en mijn kantoorgenoot uit Brussel, Edmon Oude Elferink (Europees recht).
Bijdrage ingezonden door Rogier de Vrey, CMS. In de zaak Syngenta/Octrooicentrum NL [IEF 14669] speelden aspecten van octrooirecht / aanvullend beschermingscertificaat, bestuursrecht en Europees recht. Deze zaak is behandeld door mij, tezamen met mijn Nederlandse kantoorgenoten Conny Delissen (bestuursrecht), Willem Hoorneman (net als ik octrooirecht) en mijn kantoorgenoot uit Brussel, Edmon Oude Elferink (Europees recht).
Octrooicentrum Nederland (=OCNL) heeft Syngenta op 9 december 2005 een aanvullend beschermingscertificaat verleend. Inmiddels is duidelijk, na de University of Queensland uitspraak van het HvJEU (C-630/10), dat bij het verlenen van het ABC ten onrechte niet is uitgegaan van de primair door Syngenta aangedragen Finse "combi-vergunning". Als gevolg daarvan is de duur van het certificaat een stuk korter dan deze zou zijn geweest indien de juiste vergunning zou zijn gebruikt voor de berekening van de duur. Syngenta heeft ongeveer acht jaar na de verlening van het certificaat verzocht tot correctie van de duur van het certificaat. Op het moment van dit verzoek was het certificaat nog van kracht. Dit verzoek is geweigerd door het OCNL. Het OCNL heeft tevens het door Syngenta daartegen gemaakte bezwaar ongegrond verklaard. De rechtbank Den Haag heeft vervolgens het daartegen ingestelde beroep ongegrond verklaard. Tegen deze uitspraak heeft Syngenta hoger beroep ingesteld bij de Raad van State en daarbij de voorzitter verzocht een voorlopige voorziening te treffen. Ook dit verzoek om een voorlopige voorziening is afgewezen [IEF 14023].
In de bodemprocedure in hoger beroep heeft OCNL zich op het standpunt gesteld dat er geen verplichting is om terug te komen op haar besluit tot verlening van het certificaat in 2005. Syngenta had binnen de wettelijke termijn van 6 weken (na 9 december 2005) bezwaar dienen in te stellen, wat zij niet heeft gedaan. Artikel 17 lid 2 van de Verordening 1610/96 (de Verordening) maakt dit niet anders en zou enkel verwijzen naar de mogelijkheid van bezwaar volgens de nationale procedureregels (6 weken termijn). Tevens zouden er geen nieuw gebleken feiten of veranderde omstandigheden zijn die tot heroverweging ex art. 4:6 AWB nopen. Tenslotte was OCNL van mening dat correctie van de duur derden in hun belang zou kunnen treffen.
Syngenta heeft – zeer kort gezegd – betoogd dat de interpretatie van OCNL van art. 17 lid 2 van de Verordening zich niet verhoudt met het dwingende en supranationale karakter van Verordening 1610/96, de algemene opzet en doelstelling van deze verordening en het principe van Unietrouw. Tevens zou de in art. 17 lid 2 beoogde correctiemogelijkheid zinledig worden indien een beroep hierop aan een nationale beroepstermijn van 6 weken zou worden gebonden. Het feit dat in dit geval de foutieve berekening van de geldigheidsduur van het certificaat niet het gevolg is van een fout bij de vermelding in de aanvraag van de datum van de eerste handelsvergunning, maar het gevolg van een verkeerde vergunning als uitgangspunt, kan geen beletsel zijn voor toepassing van art. 17 lid 2.
De Raad van State heeft (in de bodemprocedure) Syngenta in het gelijk gesteld en bepaald dat de geldigheidsduur van het inmiddels vervallen certificaat dient te worden verlengd tot 18 december 2015.
Met name deze ruime uitleg van artikel 17(2) en de mogelijkheid om op in principe elk moment op deze correctiemogelijkheid een beroep te doen, is interessant voor certificaathouders.
Rogier de Vrey
 Contractenrecht. Octrooirecht. Licenties. Geen FRAND, omdat LED nog niet gestandaardiseerd is. Philips bezit een portfolio aan octrooi die relevant zijn voor LED-technologie, zij heeft een licentieprogramma opgezet om hiertoe toegang te verlenen. Neolux ontwerp, fabriceert en verkoopt innovatieve LED-verlichting voor professionals. Partijen zijn in gesprek over een licentieovereenkomst, de hoogte van de toepasselijke royalty en komen tot een lump sum bedrag. Van bedreiging, misbruik van omstandigheden of strijd met mededigingsrecht om de licentieovereenkomst te sluiten met Philips is geen sprake. De rechtbank veroordeelt Neolux tot betaling van het lump sum-bedrag en het doen van kwartaalrapportage voor het bepalen van de verschuldigde royalties.
Contractenrecht. Octrooirecht. Licenties. Geen FRAND, omdat LED nog niet gestandaardiseerd is. Philips bezit een portfolio aan octrooi die relevant zijn voor LED-technologie, zij heeft een licentieprogramma opgezet om hiertoe toegang te verlenen. Neolux ontwerp, fabriceert en verkoopt innovatieve LED-verlichting voor professionals. Partijen zijn in gesprek over een licentieovereenkomst, de hoogte van de toepasselijke royalty en komen tot een lump sum bedrag. Van bedreiging, misbruik van omstandigheden of strijd met mededigingsrecht om de licentieovereenkomst te sluiten met Philips is geen sprake. De rechtbank veroordeelt Neolux tot betaling van het lump sum-bedrag en het doen van kwartaalrapportage voor het bepalen van de verschuldigde royalties. Uitspraak ingezonden door Martijn de Lange,
Uitspraak ingezonden door Martijn de Lange,  Octrooirecht. Royalty's. (De rechtsvoorganger van) Duitse verweerster Hoechst heeft in 1992 een wereldwijde niet-exclusieve licentie verleend aan verzoekster, het Amerikaanse bedrijf Genentech voor het toepassen van een bepaalde technologie waarvoor verschillende Europese en Amerikaanse octrooien zijn afgegeven. Als tegenprestatie was verzoekster gehouden eenmalige kosten te betalen (DM 20.000). Daarnaast kon zij tegen betaling van vaste royalty’s door haar met behulp van de technologie vervaardigde producten onder schriftelijk vastgelegde voorwaarden verkopen. Deze royalty’s zijn door verzoekster nooit afgedragen. In juni 2008 krijgt verzoekster een brief met verzoek om opheldering van de dochter van Hoechst Sanofi-Aventis (medeverweerster) die uit openbare informatie heeft kunnen opmaken dat verzoekster producten verkoopt (het middel Rituxan) zonder daarvoor royalty’s af te dragen.
Octrooirecht. Royalty's. (De rechtsvoorganger van) Duitse verweerster Hoechst heeft in 1992 een wereldwijde niet-exclusieve licentie verleend aan verzoekster, het Amerikaanse bedrijf Genentech voor het toepassen van een bepaalde technologie waarvoor verschillende Europese en Amerikaanse octrooien zijn afgegeven. Als tegenprestatie was verzoekster gehouden eenmalige kosten te betalen (DM 20.000). Daarnaast kon zij tegen betaling van vaste royalty’s door haar met behulp van de technologie vervaardigde producten onder schriftelijk vastgelegde voorwaarden verkopen. Deze royalty’s zijn door verzoekster nooit afgedragen. In juni 2008 krijgt verzoekster een brief met verzoek om opheldering van de dochter van Hoechst Sanofi-Aventis (medeverweerster) die uit openbare informatie heeft kunnen opmaken dat verzoekster producten verkoopt (het middel Rituxan) zonder daarvoor royalty’s af te dragen. Conclusie AG:
Conclusie AG:  Contractenrecht. X heeft een stelkozijn ontwikkeld waarvoor een octrooi is aangevraagd. Met Prostelko is een exclusieve productielicentieovereenkomst aangegaan voor 10 jaar. In eerder kort geding heeft de voorzieningenrechter beslist dat eiser het alleenrecht van Prostelko op productie, verkoop moet respecteren en exploitatie van het product niet nadelig mag beïnvloeden. Eiser ontbindt de licentieovereenkomst nadien buitengerechtelijk vanwege onrechtmatig merkgebruik van andere producten onder de naam Prostelko, het niet nakomen van verplichtingen uit licentieovereenkomst en ontbreken van zinvolle exploitatiemogelijkheden (verkoop in 2014 is 0). De staking van executie wordt afgewezen, want de website is niet door eiser vrijgegeven. De buitengerechtelijke ontbinding is evenmin succesvol.
Contractenrecht. X heeft een stelkozijn ontwikkeld waarvoor een octrooi is aangevraagd. Met Prostelko is een exclusieve productielicentieovereenkomst aangegaan voor 10 jaar. In eerder kort geding heeft de voorzieningenrechter beslist dat eiser het alleenrecht van Prostelko op productie, verkoop moet respecteren en exploitatie van het product niet nadelig mag beïnvloeden. Eiser ontbindt de licentieovereenkomst nadien buitengerechtelijk vanwege onrechtmatig merkgebruik van andere producten onder de naam Prostelko, het niet nakomen van verplichtingen uit licentieovereenkomst en ontbreken van zinvolle exploitatiemogelijkheden (verkoop in 2014 is 0). De staking van executie wordt afgewezen, want de website is niet door eiser vrijgegeven. De buitengerechtelijke ontbinding is evenmin succesvol.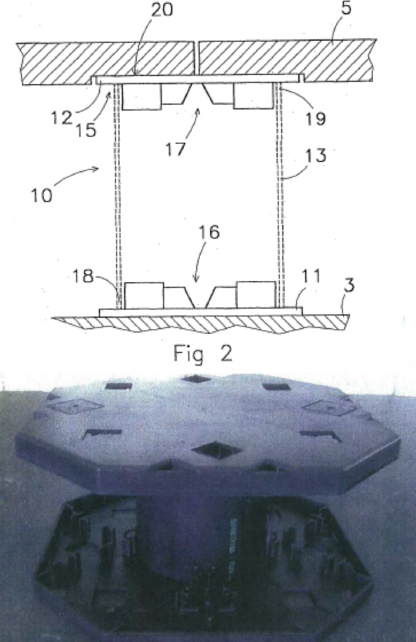 Octrooirecht. Geen inbreuk. Fixed constructions, bouw. Zoontjens Beton brengt onder het merk DNS een daknivelleringssysteem voor parkeerdaken, dakterrassen, balkons op de markt, zij is houdster van
Octrooirecht. Geen inbreuk. Fixed constructions, bouw. Zoontjens Beton brengt onder het merk DNS een daknivelleringssysteem voor parkeerdaken, dakterrassen, balkons op de markt, zij is houdster van 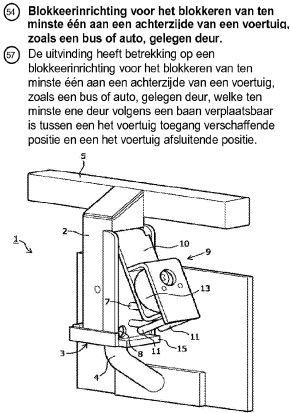 Octrooirecht. Advies ex artikel 84 Rijksoctrooiwet 1995 inzake de nieuwheid en inventiviteit van octrooi
Octrooirecht. Advies ex artikel 84 Rijksoctrooiwet 1995 inzake de nieuwheid en inventiviteit van octrooi  Uitspraak ingezonden door Rutger Kleemans en Arvid van Oorschot,
Uitspraak ingezonden door Rutger Kleemans en Arvid van Oorschot,  Conclusie ingezonden door Otto Swens en Remco de Ranitz,
Conclusie ingezonden door Otto Swens en Remco de Ranitz, 




















































































