Vragen aan HvJ EU: Levering voor studies, tests of proeven uitgesloten van octrooibescherming?
Prejudiciële vragen HvJ EU 5 december 2013, zaak C-661/13 (Astellas Pharma Inc tegen Polpharma Pharmaceutical Works)
 Verzoek gedaan door Oberlandesgericht Düsseldorf (Duitsland).
Verzoek gedaan door Oberlandesgericht Düsseldorf (Duitsland).
Octrooirecht. ABC. Verzoekster is een in Japan gevestigde farmaceutisch bedrijf met vestiging onder meer in Duitsland. Zij is houdster van een octrooi voor nieuwe chinuclidinederivaten EP0801067. Verweerster Polpharma SA Pharmaceutical Works is een POL bedrijf dat geneesmiddelen produceert en wereldwijd verhandelt. Sinds enige tijd, en sinds maart 2010 ook op haar wbsite, maakt zij reclame voor de werkzame stof solifenacinesuccinaat, een onder verzoeksters octrooi vallend chinuclidinederivaat. Zij levert deze werkzame stof onder meer aan de in Duitsland gevestigde firma Hexal AG, voor de productie van generieke geneesmiddelen.
Verzoekster start een procedure tegen Polpharma wegens inbreuk op haar octrooi. Verweerster laat dan in een schriftelijke verklaring aan verzoekster weten dat zij de werkzame stof niet meer in Duitsland zal aanbieden, in de handel brengen of gebruiken. Wel maakt zij duidelijk dat deze verklaring geen betrekking heeft op levering in het kader van proeven. Hiervoor maakt verweerster een uitzondering. Dit voorbehoud leidt ertoe dat verzoekster de zaak doorzet.
De rechter wijst verzoeksters vordering toe. Beide partijen gaan dan in beroep bij de verwijzende rechter. De belangrijkste vraag die daar ter tafel ligt is of artikel 10, lid 6, van RL 2001/83 aldus moet worden uitgelegd dat de aldaar bepaalde uitsluiting van octrooibescherming ook geldt voor handelingen van ter beschikkingstelling door derden.
De verwijzende rechter stelt het HvJ EU de volgende vragen:
1) Moet artikel 10, lid 6, van richtlijn 2001/83/EG aldus worden uitgelegd dat de uitsluiting van octrooibescherming ook geldt voor handelingen van terbeschikkingstelling waarmee een derde om louter commerciële redenen een producent van generieke geneesmiddelen een door een octrooi beschermde werkzame stof aanbiedt of levert, die de onderneming voor generieke geneesmiddelen voornemens is te gebruiken om studies, tests of proeven voor een geneesmiddelenrechtelijke vergunning voor het in de handel brengen, in de zin van artikel 10, lid 6, van richtlijn 2001/83/EG uit te voeren?
2) Indien de eerste vraag bevestigend wordt beantwoord:
a) Is het bijzondere recht van de derde afhankelijk van de vraag of de producent van generieke geneesmiddelen aan wie hij levert, de ter beschikking gestelde werkzame stof daadwerkelijk gebruikt voor onder het bijzondere recht vallende studies, tests of proeven in de zin van artikel 10, lid 6, van richtlijn 2001/83/EG? Sorteert de uitsluiting van octrooibescherming in een dergelijk geval ook effect wanneer de derde er niet van op de hoogte is dat zijn klant voornemens is om de stof te gebruiken voor doeleinden die onder het bijzondere recht vallen en hij zich daarvan ook niet heeft vergewist?
Of is voor het bijzondere recht van de derde enkel relevant dat hij op het tijdstip waarop hij de stof ter beschikking heeft gesteld, in het licht van alle omstandigheden (bijvoorbeeld de activiteiten van de
onderneming waaraan hij levert, de geringe hoeveelheid ter beschikking gestelde werkzame stof, de nakende afloop van de octrooibescherming voor de betrokken werkzame stof, ervaringen met de betrouwbaarheid van de klant) ervan mag uitgaan dat de onderneming voor generieke geneesmiddelen waaraan hij levert de ter beschikking gestelde werkzame stof uitsluitend zal gebruiken voor onder het bijzondere recht vallende studies, tests of proeven in het kader van een vergunning voor het in de handel brengen?
b) Moet de derde in het kader van de terbeschikkingstelling zelf voorzorgsmaatregelen nemen opdat zijn klant de werkzame stof daadwerkelijk enkel voor onder het bijzondere recht vallende studies, tests of proeven gebruikt, en verschillen de voorzorgsmaatregelen die hij moet nemen naargelang de door het octrooi beschermde werkzame stof slechts wordt aangeboden, dan wel ook wordt geleverd?
 Bij besluit van 23 november 2010 heeft NL Octrooicentrum een verzoek van Astion tot herstel van het op haar naam gestelde
Bij besluit van 23 november 2010 heeft NL Octrooicentrum een verzoek van Astion tot herstel van het op haar naam gestelde  Dit voorstel van rijkswet strekt tot invoering van een beperkte veredelingsvrijstelling in de Rijksoctrooiwet 1995 (ROW 1995), waarmee de innovatieve slagkracht van plantenveredelaars wordt bevorderd. Het voorstel (
Dit voorstel van rijkswet strekt tot invoering van een beperkte veredelingsvrijstelling in de Rijksoctrooiwet 1995 (ROW 1995), waarmee de innovatieve slagkracht van plantenveredelaars wordt bevorderd. Het voorstel (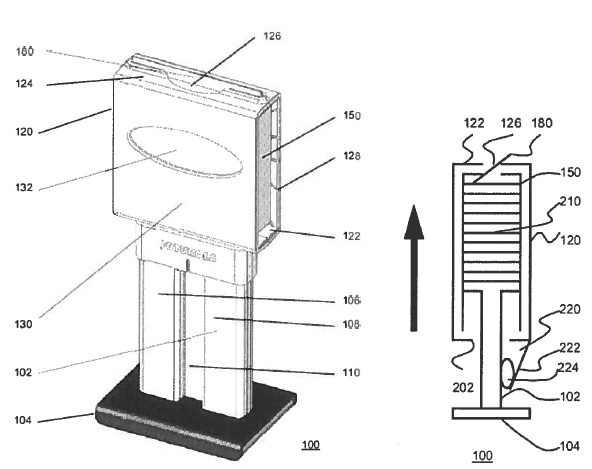 Uitspraak ingezonden door Otto Swens,
Uitspraak ingezonden door Otto Swens,  Octrooirecht. ABC. Verzoeker Arne Forsgren heeft een ABC aangevraagd hetgeen in beroep door het Oostenrijkse Patentamt bij besluit van 9 oktober 2012 is geweigerd. Het gaat om het middel Synflorix, dat de werkzame stof proteïne D bevat, waarvoor verzoeker op 30 maart 2009 een vergunning voor het in de handel brengen heeft gekregen.
Octrooirecht. ABC. Verzoeker Arne Forsgren heeft een ABC aangevraagd hetgeen in beroep door het Oostenrijkse Patentamt bij besluit van 9 oktober 2012 is geweigerd. Het gaat om het middel Synflorix, dat de werkzame stof proteïne D bevat, waarvoor verzoeker op 30 maart 2009 een vergunning voor het in de handel brengen heeft gekregen.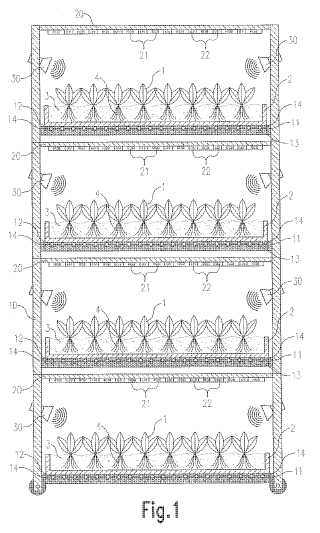 Octrooirecht. Opheffing beslag afgewezen. Partijen hebben samengewerkt waarbij een experimentele teeltruimte is gerealiseerd door eiser). Plantlab is houdster van
Octrooirecht. Opheffing beslag afgewezen. Partijen hebben samengewerkt waarbij een experimentele teeltruimte is gerealiseerd door eiser). Plantlab is houdster van  Immuniteit Europees Octrooibureau. Organisatie. Rechtspraak.nl: De VEOB en SUEPO vorderen onder meer het Europees Octrooibureau (EOB) te gebieden de schendingen van het recht op het staken en het recht op collectief onderhandelen te beëindigen. Uitgangspunt is dat aan het Europees Octrooibureau immuniteiten toekomen die noodzakelijk zijn voor de vervulling van haar officiële werkzaamheden. Dat brengt echter niet zonder meer mee dat de voorzieningenrechter zich onbevoegd dient te verklaren van het geschil kennis te nemen. Beoordeeld dient te worden of de immuniteitsverlening proportioneel is ten opzichte van het nagestreefde doel. Omdat aan de VEOB en SUEPO geen alternatieve rechtsmiddelen ter beschikking staan die hun recht op toegang tot de rechter effectief beschermen, zal het beroep van het EOB op immuniteit worden verworpen. De VEOB en SUEPO zijn ook ontvankelijk in hun vorderingen. De voorzieningenrechter is van oordeel dat de VEOB en SUEPO hun spoedeisend belang bij de vorderingen die ertoe strekken te worden erkend en toegelaten als onderhandelingspartner, onvoldoende hebben onderbouwd.
Immuniteit Europees Octrooibureau. Organisatie. Rechtspraak.nl: De VEOB en SUEPO vorderen onder meer het Europees Octrooibureau (EOB) te gebieden de schendingen van het recht op het staken en het recht op collectief onderhandelen te beëindigen. Uitgangspunt is dat aan het Europees Octrooibureau immuniteiten toekomen die noodzakelijk zijn voor de vervulling van haar officiële werkzaamheden. Dat brengt echter niet zonder meer mee dat de voorzieningenrechter zich onbevoegd dient te verklaren van het geschil kennis te nemen. Beoordeeld dient te worden of de immuniteitsverlening proportioneel is ten opzichte van het nagestreefde doel. Omdat aan de VEOB en SUEPO geen alternatieve rechtsmiddelen ter beschikking staan die hun recht op toegang tot de rechter effectief beschermen, zal het beroep van het EOB op immuniteit worden verworpen. De VEOB en SUEPO zijn ook ontvankelijk in hun vorderingen. De voorzieningenrechter is van oordeel dat de VEOB en SUEPO hun spoedeisend belang bij de vorderingen die ertoe strekken te worden erkend en toegelaten als onderhandelingspartner, onvoldoende hebben onderbouwd. Bijdrage ingezonden door Cees Mulder,
Bijdrage ingezonden door Cees Mulder,  Uitspraak ingezonden door John Allen,
Uitspraak ingezonden door John Allen,  Bijdrage ingezonden door Cees Mulder,
Bijdrage ingezonden door Cees Mulder, 




















































































