Trapezehaakinrichting
 Octrooicentrum Nederland, 23 oktober 2009, verzoeksters: MBrands International B.V. en MBrands B.V.; octrooihoudster: Handelsonderneming Kubus B.V. (met dank aan Alex Ferguson, Octrooibureau Ferguson).
Octrooicentrum Nederland, 23 oktober 2009, verzoeksters: MBrands International B.V. en MBrands B.V.; octrooihoudster: Handelsonderneming Kubus B.V. (met dank aan Alex Ferguson, Octrooibureau Ferguson).
Octrooirecht. Advies OCN ex artikel 76 ROW inzake NL octrooi m.b.t. een trapezehaakinrichting (zie eerder vonnis in KG van 15 juli 2009, IEF 8063) Beperkende werking van vóór verlening van het octrooi in de beschrijving opgenomen opmerking. Instemming van verzoeker bij de behandeling van een door de octrooihouder ingediend hulpverzoek niet langer vereist, wegens wijziging EOV:
“Octrooicentrum Nederland bevestigt dat in het verleden inderdaad de instemming van verzoeker bij de behandeling van een hulpverzoek werd vereist. Octrooicentrum Nederland heeft echter haar beleid in deze gewijzigd. Aanleiding voor deze wijziging was het in december 2007 van kracht worden van de herziening van het Europees Octrooiverdrag, het zogenaamde EPC 2000. Het nieuwe lid 3 van artikel 138 EOV bepaalt, analoog aan de rechtsgang in het kader van een Nederlandse gerechtelijke nietigheidsprocedure, dat een octrooihouder in een nietigheidsprocedure het recht heeft zijn octrooi te beperken middels gewijzigde conclusies.
“Deze wijziging van het EOV is voor Octrooicentrum Nederland de aanleiding geweest om de procedure inzake het nietigheidsadvies op dit punt nader te harmoniseren met de nieuwe bepalingen van het EOV. Weliswaar zou de houder van een Rijksoctrooi zijn octrooi kunnen beperken middels een akte van gedeeltelijke afstand, doch een verzoeker in een adviesprocedurekan deze optie blokkeren als deze een nietigheidsactie heeft ingesteld, deze ingeschreven is in het octrooiregister en verzoeker geen toestemming geeft voor het doen van gedeeltelijke afstand (zie de uitspraak van de Raad van State van 27 februari 2008, BIE 2008, nr. 17). Om ook in een dergelijk geval de houder van een Rijksoctrooi in de gelegenheid te stellen om een voorgenomen wijziging van het octrooi te laten beoordelen, is het derhalve beleid van Octrooicentrum Nederland geworden dat het iedere octrooihouder is toegestaan een daartoe strekkend hulpverzoek in een adviesprocedure in te brengen. Instemming van de verzoeker is daarbij niet meer vereist.”
Lees het advies hier.
 Rechtbank ’s-Gravenhage, 25 november 2009, HA ZA 08-3488, Hauni Maschinenbau A.G. tegen Spikker Specials
Rechtbank ’s-Gravenhage, 25 november 2009, HA ZA 08-3488, Hauni Maschinenbau A.G. tegen Spikker Specials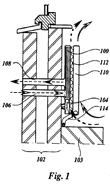 Rechtbank ’s-Gravenhage, 25 november 2009, HA ZA 08-1040, Van Holsteijn en Kemna Special Products B.V. (VHK) tegen J.E. Stork Ventilatoren B.V. (met dank aan Chantal Morel,
Rechtbank ’s-Gravenhage, 25 november 2009, HA ZA 08-1040, Van Holsteijn en Kemna Special Products B.V. (VHK) tegen J.E. Stork Ventilatoren B.V. (met dank aan Chantal Morel, 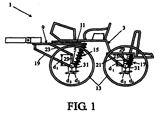
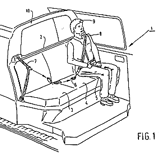 Rechtbank ’s-Gravenhage, 18 november 2009, HA ZA 08-418, ABK Kunststoffen B.V. & Transcare B.V. tegen Snoeks Automotive B.V. (met dank aan Klaas Bisschop,
Rechtbank ’s-Gravenhage, 18 november 2009, HA ZA 08-418, ABK Kunststoffen B.V. & Transcare B.V. tegen Snoeks Automotive B.V. (met dank aan Klaas Bisschop,  Octrooirecht. Over het hoofd gezien: Aankomende inwerkingtreding van wijzigingen van de Rijksoctrooiwet 1995 en bijbehorend Rijksbesluit en Regeling per 1 april 2010 (met dank aan Rolf Suurmond,
Octrooirecht. Over het hoofd gezien: Aankomende inwerkingtreding van wijzigingen van de Rijksoctrooiwet 1995 en bijbehorend Rijksbesluit en Regeling per 1 april 2010 (met dank aan Rolf Suurmond,  Rechtbank ’s-Gravenhage, sector bestuursrecht, uitspraak van 4 november 2009, AWB 08/9394, Stallergenes tegen Octrooicentrum Nederland
Rechtbank ’s-Gravenhage, sector bestuursrecht, uitspraak van 4 november 2009, AWB 08/9394, Stallergenes tegen Octrooicentrum Nederland




















































































